Алкадиены
Это класс углеводородов, содержащие две двойных
связи углерод-углерод.
Классификация
В зависимости от взаимного
расположения двойных связей диены подразделяются на три группы:
§ сопряженные диены,
в которых двойные связи разделены одинарной (1,3-диены)
§ аллены с кумулированными двойными связями (1,2-диены)
§ диены с
изолированными двойными связями, в которых двойные связи разделены несколькими
одинарными.
Гетероаналоги диенов, в которых один из ненасыщенных углеродных атомов замещён гетероатомом, называются гетеродиенами.
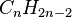 и
и  соответственно,
ациклические диены являются структурными изомерами алкинов.
соответственно,
ациклические диены являются структурными изомерами алкинов.Физические свойства
Низшие диены - бесцветные
легкокипящие жидкости (температуры кипения изопрена - 34 °C, 2,2-диметил-1,3-бутадиена — 68.78 °C, 1,3-циклопентадиена — 41.5 °C). 1,3-Бутадиен и аллен (1,2-пропадиен) —
газы (Tкип −4,5 °C и −34 °C соответственно).
Сопряженные диены существуют в виде двух конформаций - цисоидной (s-цис-форма) и трансоидной (s-транс-форма), способных
переходить друг в друга, более устойчивой является s-транс-форма:
Реакционная способность
Реакционная способнось диенов определяется спецификой сопряжения двойных связей - если для диенов с изолированными двойными связями реакционная способность аналогична реакционной способности алкенов, то в случае алленов и 1,3-диенов эффекты сопряжения ведут к специфике реакционной способности этих классов соединений.
Реакция алленов
Центральный sp-гибридизованный атом углерода в алленах является электрофильным центром, поэтому, в отличие от не активированных электронакцепторными заместителями алкенов, аллены реагируют с мягкими нуклеофилами, образуя винильные и аллильные производные:
CH2=C=CH2 + PhSH CH2=C(SPh)-CH3
+ CH2=CH-CH2SPh
Электрофильность
sp-гибридизованного атома алленов повышается электроноакцепторными группами, в
этом случае присоединение нуклеофила идет исключительно по этому атому:
CH2=C=CHCOOR + NuH CH2=CNuCH2COOR
+ CH3C(Nu)=CHCOOR
Гидратации аллена в
условиях кислотного катализа присоединение протона идёт по терминальному
углероду, образующийся при этом енол далее таутомеризуется вацетон:
CH2=С=CH2 + H2O [CH2=С(OH)CH3] CH3COCH3
Под действием щелочей или
кислот аллены могут претерпевать прототропные перегруппировки в 1,3-диены:
RCH2CH=C=CH2 RCH=CHCH=CH2
Реакции 1,3-диенов
Специфика реакционной
способности 1,3-диенов обусловлена мезомерией вследствие сопряжения двойных
связей:
Результатом является то,
что в случае электрофильного присоединения к сопряженным диенам типичны реакции
1,4-присоединения, идушие через промежуточное образование резонансно
стабилизированных аллильных карбокатионов:
CH2=CH-CH=CH2 + X+ XCH2-CH=CH-CH2+
XCH2-CH=CH-CH2+ + Y- XCH2-CH=CH-CH2Y
Х = Hal, H, Y = Hal, OH
Сопряженные диены легко
полимеризуются по механизму 1,4-присоединения, реакция полимеризации 1,3-диенов
лежат в основе синтеза диеновых каучуков.
Диены также реагируют с алкенами и другими соединениями - диенофилами с активированной электронакцепторными заместителями кратной связью, образуя продукты [4+2]-присоединения (реакция Дильса — Альдера) CH2=C=CH2 + PhSH CH2=C(SPh)-CH3 + CH2=CH-CH2SPh
Электрофильность
sp-гибридизованного атома алленов повышается электроноакцепторными группами, в
этом случае присоединение нуклеофила идет исключительно по этому атому:
CH2=C=CHCOOR + NuH CH2=CNuCH2COOR
+ CH3C(Nu)=CHCOOR
Гидратации аллена в
условиях кислотного катализа присоединение протона идёт по терминальному
углероду, образующийся при этом енол далее таутомеризуется вацетон:
CH2=С=CH2 + H2O [CH2=С(OH)CH3] CH3COCH3
Под действием щелочей или
кислот аллены могут претерпевать прототропные перегруппировки в 1,3-диены:
RCH2CH=C=CH2 RCH=CHCH=CH2
Реакции 1,3-диенов
Специфика реакционной
способности 1,3-диенов обусловлена мезомерией вследствие сопряжения двойных
связей:
Результатом является то,
что в случае электрофильного присоединения к сопряженным диенам типичны реакции
1,4-присоединения, идушие через промежуточное образование резонансно
стабилизированных аллильных карбокатионов:
CH2=CH-CH=CH2 + X+ XCH2-CH=CH-CH2+
XCH2-CH=CH-CH2+ + Y- XCH2-CH=CH-CH2Y
Х = Hal, H, Y = Hal, OH
Сопряженные диены легко
полимеризуются по механизму 1,4-присоединения, реакция полимеризации 1,3-диенов
лежат в основе синтеза диеновых каучуков.
Диены также реагируют с
алкенами и другими соединениями - диенофилами с активированной электронакцепторными
заместителями кратной связью, образуя продукты [4+2]-присоединения (реакция
Дильса — Альдера)

